Chapitre 4: La glycémie, paramètre du milieu intérieur
Page 1 sur 1 • Partagez
 Chapitre 4: La glycémie, paramètre du milieu intérieur
Chapitre 4: La glycémie, paramètre du milieu intérieur
Chapitre 4:
Le milieu intérieur est constitué de :
- Sang (55% de plasma et 45% de cellules (hématies, leucocytes)).
- Lymphe canalisée et interstitielle (plasma et leucocytes)
Le plasma sanguin va essentiellement assurer en permanence l’approvisionnement en dioxygène et en glucose nécessaire à la respiration cellulaire :
C6H12O6 + 6O2 à 6CO2 + 6H2O
Le bon fonctionnement de l’organisme dépend de l’équilibre entre les sources alimentaires et les dépenses énergétiques.
Le glucose est la molécule énergétique privilégiée utilisée en permanence par la plupart des cellules qui le prélève dans le sang.
La glycémie c’est le taux de glucose dans le sang
Comment se comporte la glycémie ?
I La glycémie est le taux de glucose plasmatique
Activité : Étude de la glycémie
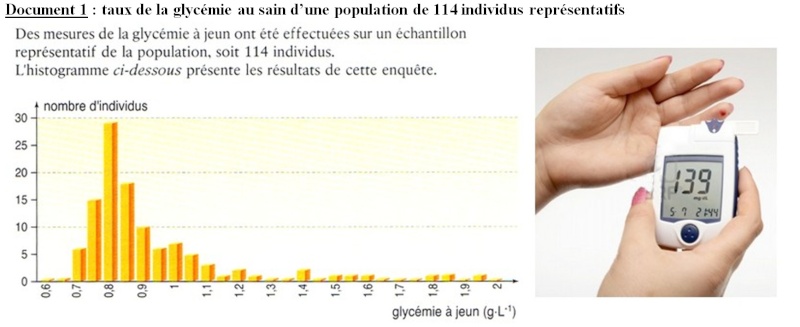
Doc 1 : Statistiquement, une grande majorité de la population à un taux de sucre dans le sang (= glycémie) compris entre 0.7 et 1 g/L. Ceci suggère que ce paramètre physiologique est bien régulé .

Doc 2 : La glycémie correspond à la concentration sanguine de glucose et elle oscille normalement autour d'une valeur moyenne proche de 1g/L appelée valeur de consigne. Chaque repas entraîne une hausse systématique de la glycémie qui revient rapidement autour de cette valeur de consigne. Le sport peut entraîner une hypoglycémie passagère


Doc 3 :
- En cas d'hypoglycémie (< 0.7 g/L), les cellules souffrent d'un manque de glucose (en particulier les cellules nerveuses pour lesquelles le glucose est leur seule source d'énergie) : une hypoglycémie sévère est mortelle.
- En cas d'hyperglycémie (> 1.2 g/L), de nombreux troubles apparaissent à la longue : sensation de soif et de faim, besoin impérieux d'uriner, problèmes visuels, fatigue et même coma dans les formes sévères.
Bilan : La glycémie (du grec glukus = doux et haima = sang) est la concentration plasmatique du glucose (quantité de glucose par volume de plasma).
Le taux de glucose plasmatique est relativement stable.
En effet, malgré des variations importantes d’apport ou de consommation de glucose (prise alimentaire, jeûne, consommation cellulaire), on constate que la glycémie reste relativement stable et oscille autour de 1g/l (ou 100 mg/dL) de glucose dans le plasma sanguin chez les personnes saines.
On parle d’homéostasie glycémique. Cette régulation est indispensable pour assurer le bon fonctionnement des cellules donc de l’organisme.
L’hyperglycémie et l’hypoglycémie sont des états physiologiques anormaux et dangereux pour la santé.
La glycémie est un paramètre du milieu intérieur. Son maintien par l'organisme dans une gamme de valeurs étroite est un indicateur et une condition de bonne santé.
D’où provient le glucose présent dans le milieu intérieur ?
II Approvisionnement sanguin de glucose
Activité : Étude de cas clinique

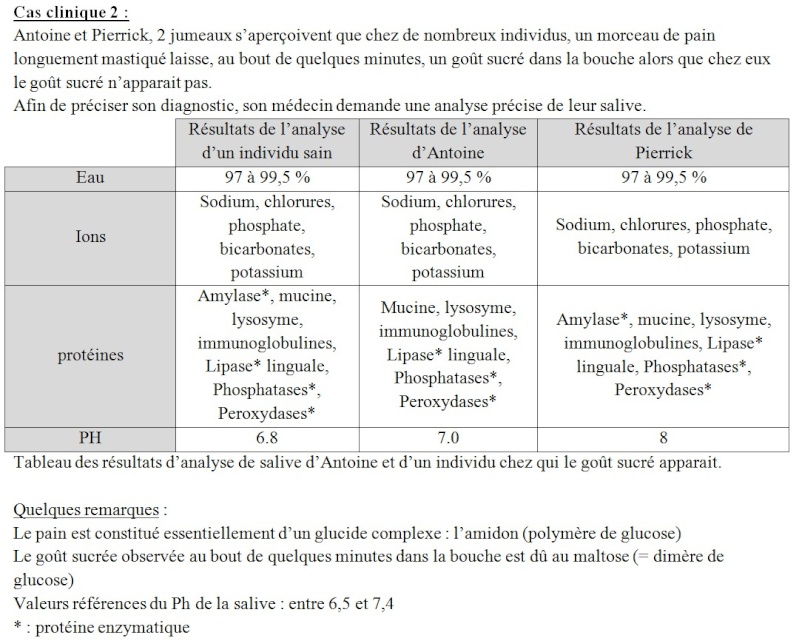
Hypothèse : le glucose sanguin proviendrait du passage du glucose au travers de la paroi intestinal.
Cependant les glucides complexes doivent être transformés en glucides simples grâce aux enzymes tels que l’amylase dans certaine condition : EX PH convenable.
A] Propriétés des enzymes (digestives)
TP : action d'une enzyme digestive de l'amidon

L'amidon, un glucide à grosse molécule est transformé grâce au HCl et à l'amylase. En réalité cette réaction est spontanée et très lente (plusieurs jours). Le HCL et l'amylase sont donc des catalyseurs. Autrement dit, ils accélèrent des réactions spontanées.
Rq : Le HCl est un catalyseur chimique et l'amylase est un catalyseur biologique, une enzyme

L'amidon se transforme en glucose et est accéléré par l'amylase. Celle ci intervenant dans le cadre de la digestion est appelée : enzyme digestive.

L'enzyme est une molécule réutilisable au cours du temps.
Rq : l’hydrolyse de l’amidon est possible en utilisant un catalyseur chimique comme l’acide chlorhydrique.
Cette hydrolyse est très différente, de l’hydrolyse enzymatique :
- L’hydrolyse est moins rapide.
- L’hydrolyse demande une concentration élevée d’HCl.
L’hydrolyse se réalise à une température extrême de 100 °C, un PH très acide (2), conditions incompatibles avec la vie cellulaire.
Bilan : Les glucides à grosses molécules des aliments sont transformés en glucose grâce à l'action d'enzymes digestives. Les enzymes sont des protéines qui catalysent des transformations chimiques existante dans l'environnement. Ces enzymes sont réutilisable au cours du temps.
B] Conditions de fonctionnement des enzymes
TP : Condition de fonctionnement des enzymes


L'amylase nécessite des conditions de T°c et de pH spécifiques pour fonctionner : 37°C et un pH de 7, soit les conditions corporelles.
Rq : Chaque enzyme nécessite des conditions particulières pour fonctionner correctement : ceux sont les optimums de fonctionnement.
Le fait qu’Antoine ne ressent pas de goût sucré s’explique par l’absence d’amylase salivaire cependant il présente d’autres enzymes digestives
Comment expliquer que les autres enzymes ne permettent pas d’hydrolyser l’amidon ?
Hypothèse : les autres enzymes ne permettent pas d’hydrolyser l’amidon car une enzyme est spécifique d’un substrat et/ou d’une réaction chimique
C] Spécificités des enzymes
TP spécificités des enzymes

- On observe que l’amylase n’a été capable de catalyser que la réaction d’hydrolyse de l’amidon, on en conclu que les enzymes sont spécifiques d’un type de substrat
- On observe que le substrat pyruvate peut être transformer en différents produits suivant le type de réaction or on observe que suivant la réaction se ne sont pas les mêmes enzymes qui sont impliqués, on en conclu que les enzymes sont spécifiques d’un type de réaction chimique (catalyse un seul type de réaction)
Bilan : les enzymes sont des biocatalyseurs spécifiques : spécifiques d’un type de substrat et d’un type de réaction.
Les enzymes sont capables d’accélérer la vitesse de réaction chimique que dans certaines conditions environnementales les rendant ainsi compatibles avec la vie
Les enzymes en catalysant les réactions de transformation des grosses molécules de glucides en sucres réducteurs, elles permettent leurs passage au niveau de l’intestin grêle dans le sang et donc l’approvisionnement sanguin.
Comment agissent les enzymes sur le substrat permettant d’expliquer qu’elles sont capables d’accélérer la transformation spécifique d’un seul type de substrat sans être elle-même modifiée ? Et comment expliquer qu’elles n’agissent que dans certaines conditions de PH et de température ?

Hypothèse :
H1 : Une enzyme agit par contact direct sur substrat d’où reconnaissance d’un seul type de substrat (complémentarité de forme) et ne catalyse qu’un seul type de réaction
H2 : La modification t° et PH modifie la structure de l’enzyme
III Les modalités de l’activité enzymatique
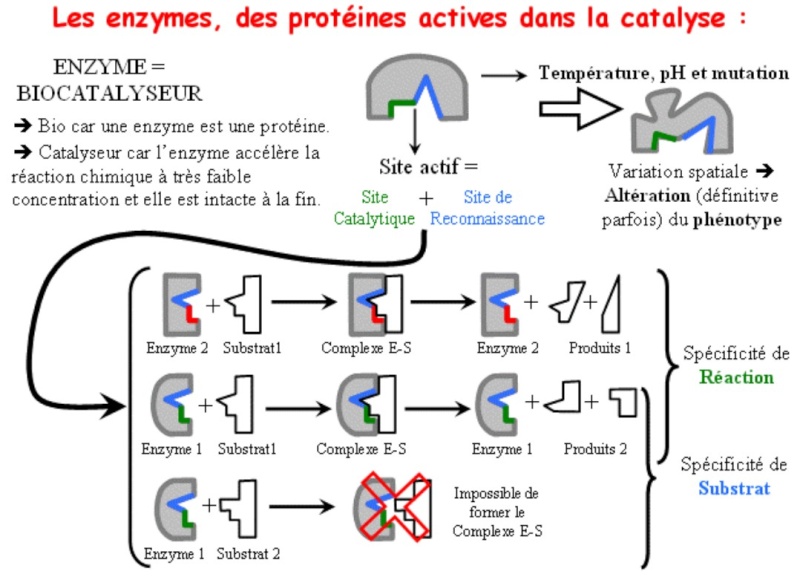
Document : mode d’action des enzymes

L’enzyme présentée ici, le lysozyme, est une enzyme présente dans de nombreuses sécrétions (larmes, mucus nasal, salive ….) Elle catalyse des réactions de dégradation de la paroi de certaines bactéries.
a) Représentation spatiale du substrat (S) et de l’enzyme (E)
b) Représentation du complexe enzyme–substrat.
Doc1 : les enzymes agissent par fixation du substrat dans une cavité qui présente une forme complémentaire du substrat : formation d’un complexe enzyme substrat (ES)

Doc2 : on apprend que la cavité où se loge le substrat est le site actif de l’enzyme.
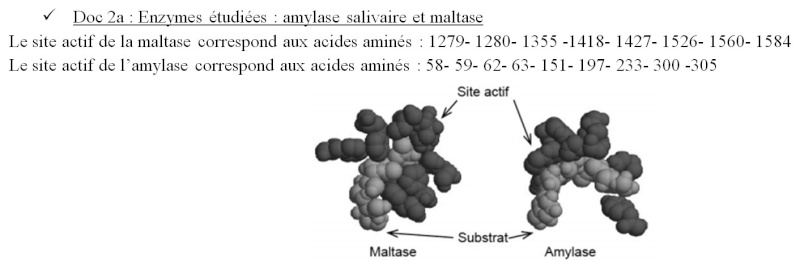
Doc2a : On observe que seuls quelques acides aminés sont impliqués dans le site actif (acides aminés parfois éloignés dans la structure primaire mais proche dans la structure spatiale permettant de formé le site actif dû au reploiement de la protéine (dû séquence aa et interactions entre eux) ).
On observe que le site actif présente des formes différentes suivant les enzymes. Donc chaque enzyme ne peut être complémentaire que d’un seul type de substrat : spécificité de substrat

Doc 2b : le changement de la séquence primaire (tryptophane remplacé par alanine au niveau du 58ème AA, entraîne la modification de la forme 3D au niveau du site actif ce qui a pour conséquence d’avoir une répercussion sur l’activité de l’enzyme (la forme variante TRPmut (350)est beaucoup moins active que la forme normale (66212))
Rq : Parallèle à faire avec PH et t° qui dénature la protéine est donc modifie site actif ce qui a pour conséquence de modifier l’activité des enzymes.
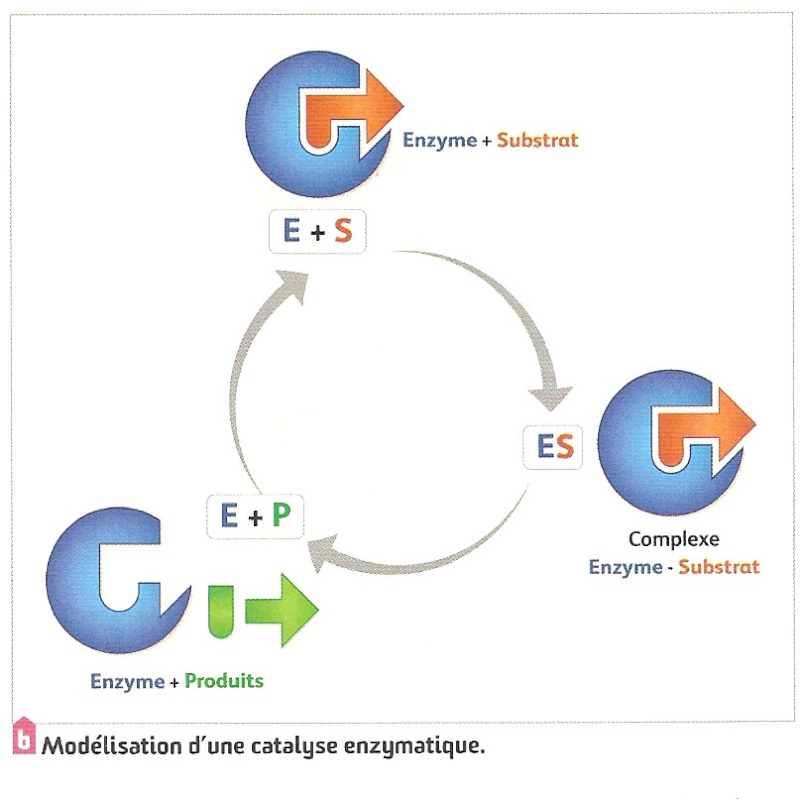
Bilan : l’enzyme possède un site actif (site de reconnaissance + site catalytique) complémentaire du substrat permettant la formation d’un complexe enzyme-substrat et donc favorisant l’activité catalytique de l’enzyme ce qui explique la spécificité de substrat et d’action des enzymes. Les conditions environnementales (PH et Température) peuvent dénaturer la protéine et donc modifier la forme du site actif rendant les enzymes non fonctionnelles.

Les enzymes sont des protéines qui catalysent des transformations chimiques spécifiques (ici celles de la digestions)
Le milieu intérieur est constitué de :
- Sang (55% de plasma et 45% de cellules (hématies, leucocytes)).
- Lymphe canalisée et interstitielle (plasma et leucocytes)
Le plasma sanguin va essentiellement assurer en permanence l’approvisionnement en dioxygène et en glucose nécessaire à la respiration cellulaire :
C6H12O6 + 6O2 à 6CO2 + 6H2O
Le bon fonctionnement de l’organisme dépend de l’équilibre entre les sources alimentaires et les dépenses énergétiques.
Le glucose est la molécule énergétique privilégiée utilisée en permanence par la plupart des cellules qui le prélève dans le sang.
La glycémie c’est le taux de glucose dans le sang
Comment se comporte la glycémie ?
La glycémie, paramètre du milieu intérieur
I La glycémie est le taux de glucose plasmatique
Activité : Étude de la glycémie

Doc 1 : Statistiquement, une grande majorité de la population à un taux de sucre dans le sang (= glycémie) compris entre 0.7 et 1 g/L. Ceci suggère que ce paramètre physiologique est bien régulé .

Doc 2 : La glycémie correspond à la concentration sanguine de glucose et elle oscille normalement autour d'une valeur moyenne proche de 1g/L appelée valeur de consigne. Chaque repas entraîne une hausse systématique de la glycémie qui revient rapidement autour de cette valeur de consigne. Le sport peut entraîner une hypoglycémie passagère


Doc 3 :
- En cas d'hypoglycémie (< 0.7 g/L), les cellules souffrent d'un manque de glucose (en particulier les cellules nerveuses pour lesquelles le glucose est leur seule source d'énergie) : une hypoglycémie sévère est mortelle.
- En cas d'hyperglycémie (> 1.2 g/L), de nombreux troubles apparaissent à la longue : sensation de soif et de faim, besoin impérieux d'uriner, problèmes visuels, fatigue et même coma dans les formes sévères.
Bilan : La glycémie (du grec glukus = doux et haima = sang) est la concentration plasmatique du glucose (quantité de glucose par volume de plasma).
Le taux de glucose plasmatique est relativement stable.
En effet, malgré des variations importantes d’apport ou de consommation de glucose (prise alimentaire, jeûne, consommation cellulaire), on constate que la glycémie reste relativement stable et oscille autour de 1g/l (ou 100 mg/dL) de glucose dans le plasma sanguin chez les personnes saines.
On parle d’homéostasie glycémique. Cette régulation est indispensable pour assurer le bon fonctionnement des cellules donc de l’organisme.
L’hyperglycémie et l’hypoglycémie sont des états physiologiques anormaux et dangereux pour la santé.
La glycémie est un paramètre du milieu intérieur. Son maintien par l'organisme dans une gamme de valeurs étroite est un indicateur et une condition de bonne santé.
D’où provient le glucose présent dans le milieu intérieur ?
II Approvisionnement sanguin de glucose
Activité : Étude de cas clinique


Hypothèse : le glucose sanguin proviendrait du passage du glucose au travers de la paroi intestinal.
Cependant les glucides complexes doivent être transformés en glucides simples grâce aux enzymes tels que l’amylase dans certaine condition : EX PH convenable.
A] Propriétés des enzymes (digestives)
TP : action d'une enzyme digestive de l'amidon

L'amidon, un glucide à grosse molécule est transformé grâce au HCl et à l'amylase. En réalité cette réaction est spontanée et très lente (plusieurs jours). Le HCL et l'amylase sont donc des catalyseurs. Autrement dit, ils accélèrent des réactions spontanées.
Rq : Le HCl est un catalyseur chimique et l'amylase est un catalyseur biologique, une enzyme

L'amidon se transforme en glucose et est accéléré par l'amylase. Celle ci intervenant dans le cadre de la digestion est appelée : enzyme digestive.

L'enzyme est une molécule réutilisable au cours du temps.
Rq : l’hydrolyse de l’amidon est possible en utilisant un catalyseur chimique comme l’acide chlorhydrique.
Cette hydrolyse est très différente, de l’hydrolyse enzymatique :
- L’hydrolyse est moins rapide.
- L’hydrolyse demande une concentration élevée d’HCl.
L’hydrolyse se réalise à une température extrême de 100 °C, un PH très acide (2), conditions incompatibles avec la vie cellulaire.
Bilan : Les glucides à grosses molécules des aliments sont transformés en glucose grâce à l'action d'enzymes digestives. Les enzymes sont des protéines qui catalysent des transformations chimiques existante dans l'environnement. Ces enzymes sont réutilisable au cours du temps.
B] Conditions de fonctionnement des enzymes
TP : Condition de fonctionnement des enzymes


L'amylase nécessite des conditions de T°c et de pH spécifiques pour fonctionner : 37°C et un pH de 7, soit les conditions corporelles.
Rq : Chaque enzyme nécessite des conditions particulières pour fonctionner correctement : ceux sont les optimums de fonctionnement.
Le fait qu’Antoine ne ressent pas de goût sucré s’explique par l’absence d’amylase salivaire cependant il présente d’autres enzymes digestives
Comment expliquer que les autres enzymes ne permettent pas d’hydrolyser l’amidon ?
Hypothèse : les autres enzymes ne permettent pas d’hydrolyser l’amidon car une enzyme est spécifique d’un substrat et/ou d’une réaction chimique
C] Spécificités des enzymes
TP spécificités des enzymes

- On observe que l’amylase n’a été capable de catalyser que la réaction d’hydrolyse de l’amidon, on en conclu que les enzymes sont spécifiques d’un type de substrat
- On observe que le substrat pyruvate peut être transformer en différents produits suivant le type de réaction or on observe que suivant la réaction se ne sont pas les mêmes enzymes qui sont impliqués, on en conclu que les enzymes sont spécifiques d’un type de réaction chimique (catalyse un seul type de réaction)
Bilan : les enzymes sont des biocatalyseurs spécifiques : spécifiques d’un type de substrat et d’un type de réaction.
Les enzymes sont capables d’accélérer la vitesse de réaction chimique que dans certaines conditions environnementales les rendant ainsi compatibles avec la vie
Les enzymes en catalysant les réactions de transformation des grosses molécules de glucides en sucres réducteurs, elles permettent leurs passage au niveau de l’intestin grêle dans le sang et donc l’approvisionnement sanguin.
Comment agissent les enzymes sur le substrat permettant d’expliquer qu’elles sont capables d’accélérer la transformation spécifique d’un seul type de substrat sans être elle-même modifiée ? Et comment expliquer qu’elles n’agissent que dans certaines conditions de PH et de température ?

Hypothèse :
H1 : Une enzyme agit par contact direct sur substrat d’où reconnaissance d’un seul type de substrat (complémentarité de forme) et ne catalyse qu’un seul type de réaction
H2 : La modification t° et PH modifie la structure de l’enzyme
III Les modalités de l’activité enzymatique
Document : mode d’action des enzymes

L’enzyme présentée ici, le lysozyme, est une enzyme présente dans de nombreuses sécrétions (larmes, mucus nasal, salive ….) Elle catalyse des réactions de dégradation de la paroi de certaines bactéries.
a) Représentation spatiale du substrat (S) et de l’enzyme (E)
b) Représentation du complexe enzyme–substrat.
Doc1 : les enzymes agissent par fixation du substrat dans une cavité qui présente une forme complémentaire du substrat : formation d’un complexe enzyme substrat (ES)

Doc2 : on apprend que la cavité où se loge le substrat est le site actif de l’enzyme.

Doc2a : On observe que seuls quelques acides aminés sont impliqués dans le site actif (acides aminés parfois éloignés dans la structure primaire mais proche dans la structure spatiale permettant de formé le site actif dû au reploiement de la protéine (dû séquence aa et interactions entre eux) ).
On observe que le site actif présente des formes différentes suivant les enzymes. Donc chaque enzyme ne peut être complémentaire que d’un seul type de substrat : spécificité de substrat

Doc 2b : le changement de la séquence primaire (tryptophane remplacé par alanine au niveau du 58ème AA, entraîne la modification de la forme 3D au niveau du site actif ce qui a pour conséquence d’avoir une répercussion sur l’activité de l’enzyme (la forme variante TRPmut (350)est beaucoup moins active que la forme normale (66212))
Rq : Parallèle à faire avec PH et t° qui dénature la protéine est donc modifie site actif ce qui a pour conséquence de modifier l’activité des enzymes.

Bilan : l’enzyme possède un site actif (site de reconnaissance + site catalytique) complémentaire du substrat permettant la formation d’un complexe enzyme-substrat et donc favorisant l’activité catalytique de l’enzyme ce qui explique la spécificité de substrat et d’action des enzymes. Les conditions environnementales (PH et Température) peuvent dénaturer la protéine et donc modifier la forme du site actif rendant les enzymes non fonctionnelles.


Les enzymes sont des protéines qui catalysent des transformations chimiques spécifiques (ici celles de la digestions)
 Sujets similaires
Sujets similaires» Chapitre 5 La glycémie et sa régulation
» la notion du cours de:l'intalation des plantes a fleurs dans le milieu
» Chapitre 10
» chapitre 7
» Ds svt chapitre 1
» la notion du cours de:l'intalation des plantes a fleurs dans le milieu
» Chapitre 10
» chapitre 7
» Ds svt chapitre 1
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum|
|
|
